Alcanos: los hidrocarburos saturados
Los alcanos son compuestos orgánicos formados solo por átomos de carbono e hidrógeno, unidos por enlaces simples. Constituyen la base del petróleo y el gas natural, y siguen la fórmula general CnH2n+2
- Poco reactivos No se combinan fácilmente con otras sustancias.
- Son Combustibles Al quemarse producen energía, dióxiodo de carbono y agua.
- Enlaces simples Todos los átomos de carbono se unen con enlaces simples entre ellos.
Ejemplo de Alcano
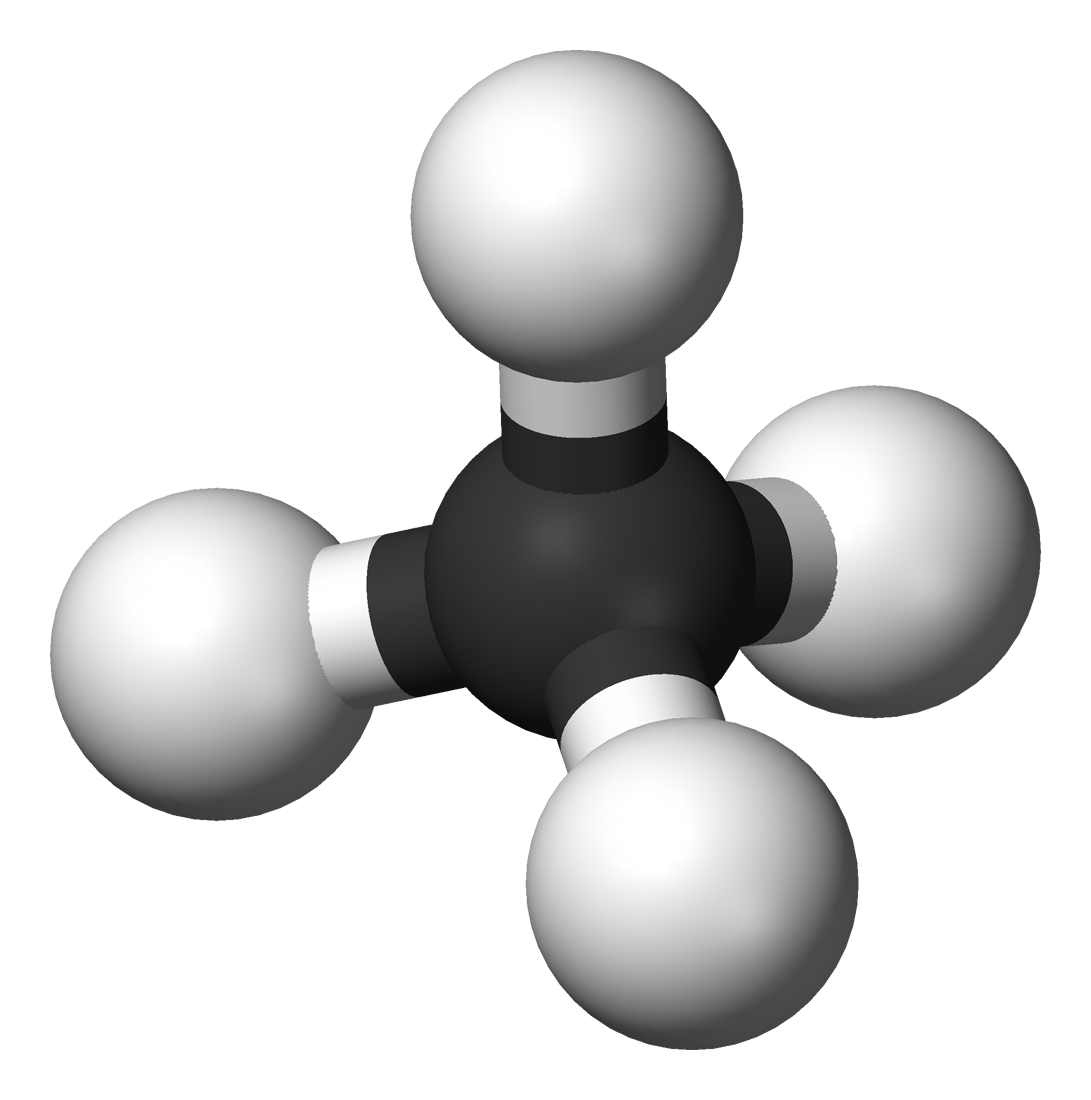
1) ¿Qué son los alcanos?
Son hidrocarburos saturados (solo enlaces simples) de fórmula CnH2n+2 (si son acíclicos). Forman una serie homóloga donde cada miembro difiere del siguiente por un grupo –CH2–. Los primeros son: metano, etano, propano, butano…
¿Y los cicloalcanos?
En anillos (cicloalcanos) la fórmula cambia a CnH2n porque se “pierden” dos hidrógenos al cerrar el ciclo. Siguen siendo saturados.
2) Características
Formados solo por carbono e hidrógeno
No tienen oxígeno, nitrógeno u otros elementos.Enlaces simples
Todos los átomos de carbono se unen con uniones “simples”, nunca dobles o triples.Hidrocarburos saturados
Cada carbono está unido al mayor número de hidrógenos que puede soportar.Fórmula general
Cumplen la regla: CnH2n+2, donde n es el número de carbonos.Serie homóloga
Se parecen entre sí: cada alcano siguiente tiene un carbono y dos hidrógenos más que el anterior.Incoloros e inodoros
No tienen color ni olor propio (aunque en el gas doméstico se les agrega un olor artificial para detectar fugas).Muy estables
No reaccionan fácilmente con otras sustancias.Inflamables
Prenden fuego con facilidad, aunque algunos (como el metano) necesitan cierta concentración en el aire para explotar.Estados físicos:
- Con 1 a 4 carbonos: gases (metano, etano, propano, butano).
- De 5 a 16 carbonos: líquidos (como la gasolina o el queroseno).
- Con más de 16 carbonos: sólidos o semisólidos (parafinas, ceras).
3) Nomenclatura IUPAC básica
- Cadena principal: la más larga con más sustituyentes si hay empate.
- Numeración: desde el extremo más cercano al primer sustituyente.
- Sustituyentes: metil (–CH3), etil (–C2H5), etc.
- Prefijos de cantidad: di-, tri-, tetra-…
- Orden alfabético: ignora di-, tri- (considera iso-, neo-).
- Nombre: localizadores + sustituyentes + raíz (met-, et-, prop-, but-, pent-, …) + -ano.
Ejemplos
 Propano.
Propano.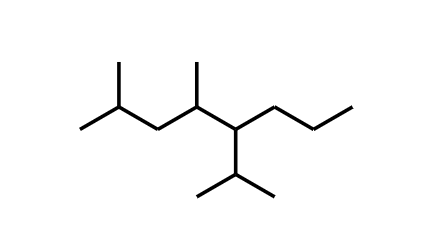 2,4-dimetil-5-isopropiloctano.
2,4-dimetil-5-isopropiloctano.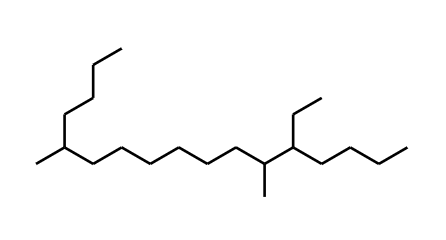 2-butil-10-etil-9-metiltetradecano.
2-butil-10-etil-9-metiltetradecano.
Errores comunes
- Olvidar la menor numeración posible.
- No usar orden alfabético de sustituyentes.
- Elegir una cadena principal que no sea la más larga.
4) Obtención y fuentes
- Gas natural: principalmente metano; también etano y propano.
- Petróleo: destilación fraccionada → gases licuados, nafta, queroseno, diésel, lubricantes, parafinas.
- Síntesis en laboratorio:
- Hidrogenación de alquenos/aldehídos/cetonas.
- Wurtz (acoplamiento de halogenuros de alquilo con Na → alcano más largo). (Nivel ampliado)
5) Usos, seguridad e impacto
Usos
- Combustibles (metano, propano, butano, gasolinas).
- Parafinas para velas, ceras, recubrimientos.
- Disolventes alifáticos y materia prima petroquímica.
Medidas de seguridad
- Inflamables: ventilar y evitar chispas.
- Emisiones: CO2 en combustión; el metano es gas de efecto invernadero potente.
- Fugas: revisar sellos en instalaciones de gas.
6) Serie homóloga (CnH2n+2)
Valores típicos (aprox.) a 1 atm. Los puntos de ebullición dependen del isómero y la pureza.
| n | Nombre | Fórmula | Masa molar (g/mol) | Estado (25 °C) | PE (°C) |
|---|
7) Calculadora de alcanos
Ingresa n (número de carbonos) para obtener la fórmula, número de hidrógenos y masa molar aproximada.
Balance de combustión
—
Consejo: para evitar fracciones, multiplica todos los coeficientes por 2.8) Ejercicios resueltos
Ejemplo 1: Nombra el compuesto 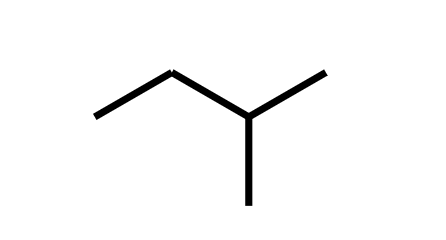
Cadena principal de 4 carbonos → butano. Sustituyente metil en C-2 (Contamos de derecha a izquierda para tener los números más pequeños) → 2-metilbutano.
Ejemplo 2: Nombra el compuesto 
Cadena principal de 5 carbonos → pentano. Dos sustituyentes metil en C-2 y C-3 (Contamos de derecha a izquierda para tener los números más pequeños) → 2,3-dimetilpentano.
9) Quiz de práctica
(1) La fórmula general de un alcano acíclico es:
(2) El etano a 25°C se encuentra en estado:
(3) Selecione el que NO es un proceso de obtención de Alcanos:
(4) El nombre correcto para CH3–CH(CH3)–CH3 es:
(5) Elija el que es un uso de los alcanos:
(6) Un compuesto de fórmula C6H12 es:
10) Glosario
- Serie homóloga: conjunto de compuestos que difieren por –CH2–.
- Parafinas: mezclas de hidrocarburos, usualmente derivadas del petróleo, que a temperatura ambiente se presentan como sólidos cerosos, incoloros e inodoros,
- Isómero: compuesto químico que tiene la misma fórmula molecular (es decir, el mismo número y tipo de átomos) que otro compuesto, pero con una estructura molecular diferente.
- Saturados: Tienen la mayor cantidad de hidrógenos posible.
- Sustituyentes: También llamadas ramificaciones, son los alcanos que no pertenecen a la cadena principal.
11) Sugerencias de estudio
- Practica nombrando compuestos a partir de esqueletos.
- Practica dibujando esqueletos a parir de nombres